Historien om ductus venosus
Publisert 12. desember 2015
Av Torvid Kiserud. Kvinneklinikken, Haukeland Universitetssjukehus og Institutt for klinisk medisin, Universitetet i Bergen
En foster-shunt ble født i 1561. Den var ikke stor den slanke, basunlignende venen på undersiden av leveren (figur 1). Den ble døpt ductus venosus fordi den førte venøst blod fra navlevenen direkte til vena cava inferior og hjertet, og den fikk det latinske tilleggsnavnet Arantii etter den kjente anatomen Aranzi i Padova på den tiden. Nederlenderen Vesalius som besøkte Aranzi, skal ha påvist shunten i 1561 og publiserte funnet to år senere1, 2.

Figur 1. Anatomisk fremstilling av ductus venosus gir ofte et forvrengt bilde av relasjoner og funksjon. Her minner anatomien mer om slik den finnes hos lammefoster som har leveren rotert langs vena cava inferior (VCI) og en tjukk ductus venosus munner inn langt fra hjertet (Grey’s Anatomy; Wikipedia).
Den fysiologiske forståelsen av ductus venosus gjorde et sprang da William Harvey på 1700-tallet klargjorde hvordan blodet sirkulerte i kroppen. I 1766 referer Albrech von Haller (Sveits) til dyreforsøk som viser at luft og væske injisert i navlevenen (eller vena cava inferior) strømmer til venstre atrium gjennom foramen ovale (historisk oppsummering av Dawes2). Da oppstod forestillingen om at alt blod i vena cava og ductus venosus strømmet gjennom foramen ovale til venstre atrium hos fosteret (Sabatier i Frankrike, 1774), mens tyskerne Wolff og Kilian mente bare 2/3 av blodet i vena cava inferior gikk til venstre hjertehalvdel. Med mer systematisk fysiologisk tenkning og eksperimenter på 1800- og 1900-tallet fester konseptet seg om en via dextra med lavt oksygeninnhold og en via sinistra med høy oksygen-transport (figur 2).

Figur 2. Ductus venosus (DV) er en viktig del av via sinistra (rød) som fører oksygenert blod fra umbilicalvenen (UV) gjennom foramen ovale (FO) til venstre forkammer (LA) og ventrikkel (LV) for å nå koronarkar og hjerne via aorta (AO) og til sist desenderende AO. Oksygenfattig blod fra vena cava superior (VCS) og inferior (VCI) følger via dextra (blå) gjennom høyre atrium (RA) og ventrikkel (RV), pulmonalarterie (PA) og ductus venosus til desender- ende AO. I motsetning til i Fig 1, er DV tynn basun-formet og munner nærmest direkte inn i hjertet fordi leveren ligge tett opptil forkammeret bare adskilt av diafragma.
Med mulighetene til angiografi fremstiller Jon Lind i 1949 fordelingen av navleveneblodet og demonstrerer samtidig hvordan den oppadstigende blodsøylen i vena cava inferior kløves av foramen ovale-kanten (atrieseptum) i en strøm til venstre og en strøm til høyre atrium (figur 3)3. Det motbeviser at blodet fra vena cava inferior og ductus venosus først når høyre atrium for så å gå lateralt gjennom foramen ovale til venstre. Vena cava inferior er i fosterlivet dedikert begge atrier og sender blod direkte til venstre eller høyre atrium.

Figur 3. Angiografi av 21 ukers foster viser kontrastfylning av umbilikalvene (UV), portvenegrener i leveren, ductus venosus (DV) og vena cava inferior. Crista dividens (hvit pil), dvs. kanten av foramen ovale i atrie septum, kløyver den oppadstigende blodsøylen i en venstre gren til venstre atrium og til- svarende til høyre. (J Lind 1953).
Med radioaktive mikrosferer kan Behrman (1970) og Rudolph (1971) vise at omtrent 50% av navlevenens oksygenrike blod shuntes forbi leveren i ductus venosus og fordeles fra venstre hjertehalvdel til koronarsirkulasjonen og hjernen4, 5. Begrepet ”preferential streaming” blir nå en mer fysiologisk betegnelse på via sinistra.
Ved hjelp av ultralyd kunne blodstrømmen i ductus venosus i 1991 visualiseres i pågående normale svangerskap hos mennesket6, 7. Det viste seg at blod ble akselerert til høy hastighet i denne shunten. Nærmest som en dyse ble høyt oksygenert blod sprøytet mot foramen ovale, foramen ovale klaffen ble blåst opp som et seil (figur 4 og 5) og blodet nådde direkte inn i venstre forkammer6, 8. Den fysiologiske betydningen var åpenbart viktig, og det diagnostiske potensialet stort9, 10.
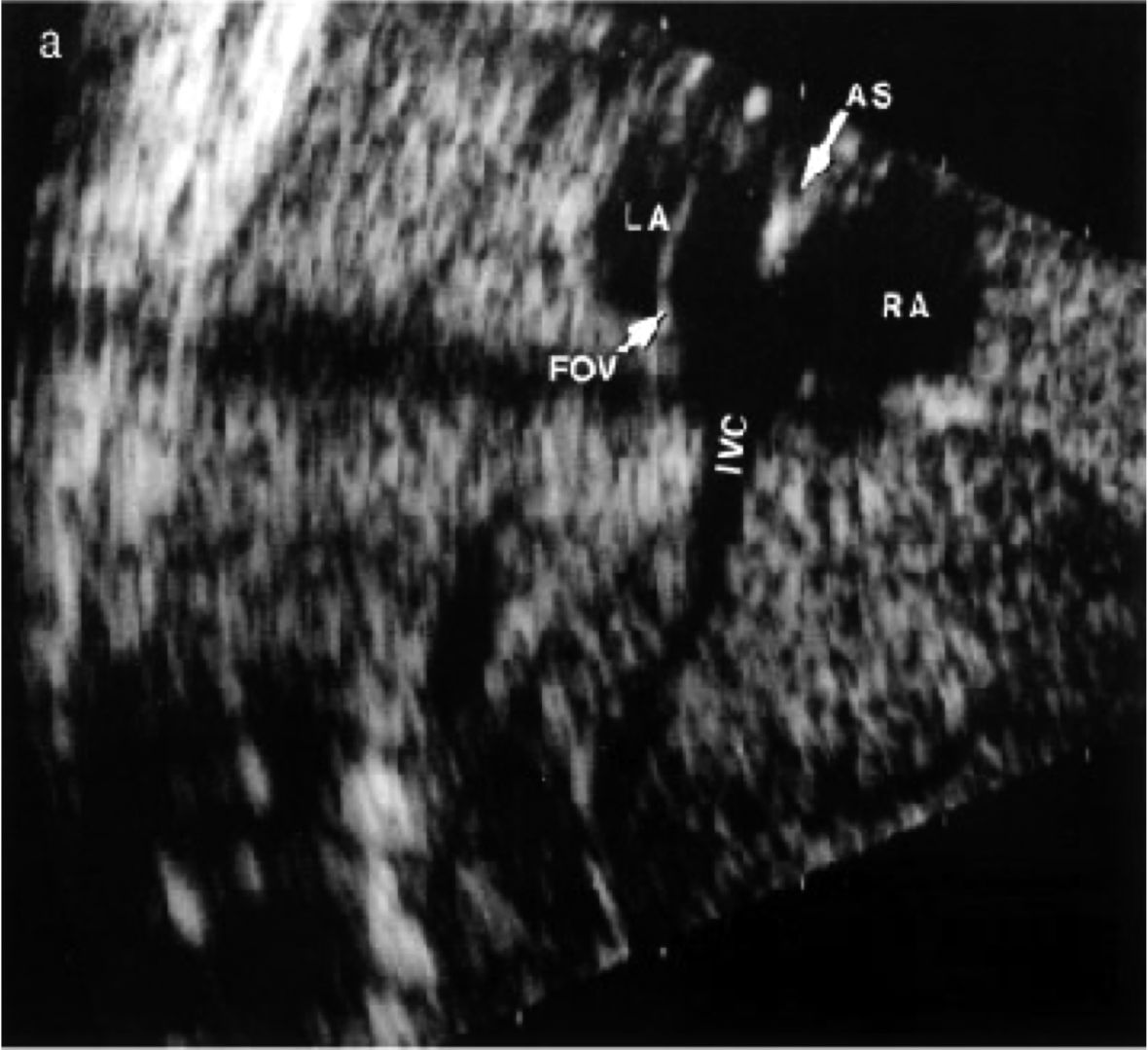
Figur 4. Ultralyd av 23 ukers foster viser en tynn abdominal vena cava inferior (IVC) som utvides mot venstre like før innmunningen i hjertet. Her treffer ductus venosus blodet med høy hastighet og fortsetter oppover langs foramen oval klaffen (FOV) med retning mot venstre atrium (LA), mens blodet fra abdomen løper noe til høyre i retning høyre atrium (RA). Blodsøylen splittes ikke før den når crista dividens av atrie-septum (AS). I fosterlivet er altså IVC dedikert begge atrier.

Figur 5. Ductus venosus (DV) fremstilt med høye hastigheter i fargedoppler der pilen viser inn- gangen og retningen. Blodstrømmen i umbilikalvenen vises ikke pga lave hastigheter. AS = atrieseptum og S = ryggsøylen.
Hemodynamikk
I de følgende årene kunne ny kunnskap om fysiologien hos humane fostre beskrives. I motsetning til de eksperimentelle studiene med 50% shunting, var det hos mennesket bare 30% umbilikalblod som gikk gjennom ductus venosus i uke 20, og ved uke 30 var andelen sunket til 20% og forble uendret til terminen11. Ved placentasvikt og veksthemning kunne graden av shunting øke til det dobbelte eller mer12, 13.
Leverens betydning
Når så lite som 20-30% shuntes gjennom ductus venosus, må det bety at fosterets lever er høyere prioritert under normale forhold, leveren får 70-80% av alt navleveneblod! På 2000-tallet brettes dette ut i detalj. Fosterleveren viser seg å være fosterets ”metabolske hjerne”. Den oppfatter blodstrømsvolum og sammensetning og induserer tilsvarende levercelle-proliferasjon og produksjon av IGF-1 og IGF-2 som bestemmer individualisert vekst i kroppens organer14, 15. Dermed er ductus også blitt en del av reguleringen av fostervekst16-18. Ved akutt og kronisk hypoksi, distenderes ductus og mer blod føres til hjerte og hjerne på bekostning av leveren19-23. Leveren responderer på slike forhold med redusert vekst, redusert IGF-produksjon og nedregulert organvekst generelt i fosterkroppen. I dag vet vi at fosterets fettdeponering i stor grad er styrt fosterleveren og at denne fettdeponeringen kan forfølges i barnealderen og sannsynligvis bidrar til økt risiko for adipositas17.
Regulering og fordeling
Sammen med venolene i leveren regulerer ductus venosus trykket i umbilikalvenen og fordelingen av blod til lever eller hjerte24-26, men blodets viskositet (hematokritt) påvirker også disse to ulikt, dvs. motstanden øker mest i lavhastighetsstrømmen i lever-karsengen og lite i høyhastighetsstrømmen i ductus27. Hastigheten i ductus-blodstrømmen kan omregnes til trykk-gradient (vanligvis 0,5-3,5mmHg) som også er det trykket som sørger for umbilikalblod gjennom leveren25. Det er vanlige vaskulære mekanismer via endotelet som regulerer diameteren og den mest uttalte diameterøkningen kommer ved hypoksi og acidose23, 28.
Pulsatil blodstrøm
Ductus venosus har oftest et pulsatilt mønster som avspeiler hjertefunksjonen fordi trykkbølgene fra hjertets forskjellige faser brer seg langs vena cava inferior og ductus venosus10, 29, 30. Det var derfor klart allerede på 1990-tallet at diastolisk funksjon kunne avleses ved å se på bølgeformen, det ble klart ved hjertemisdannelser, tachykardier og placentasvikt. Doppler-målingene var blitt standardisert6, 31, 32, longitudinelle referanseverdier ble etablert7, 33 og det viste seg at pulsatiliten gjerne ble aksentuert når belastningen på hjerte økte eller når hypoksi og acidose hemmet kontraktil kraft i hjertemuskelen. Dette er i dag utnyttet til monitorering av foster med morkakesvikt34 og de med kardiogen svikt35, og innført som diagnostikk i første trimester36, 37.
Postnatal ductus venosus
I likhet med de andre shuntene, ductus arteriosus og foramen oval, forblir ductus venosus åpen i transisjonstiden. Ductus venosus oblitererer 1-3 uker etter fødselen, tidligst hos de friske født til terminen, senest hos de som er født prematurt og de som har kardiopulmonale problem i nyfødtperioden38-40.
I 2015 er Doppler-undersøkelse av ductus venosus en nyttig diagnostisk metode og i vanlig bruk i fosterovervåkningen over hele verden.
Referanser
1. Barclay DM, Franklin KJ, Prichard MML. The foetal circulation and cardiovascular system, and the changes that they undergo at birth. Oxford: Blackwell Scientific Publications, Ltd.; 1944.
2. Dawes GS, ed. Physiological changes in the circulation after birth. Bethesda, Maryland: American Physiological Society; 1982.
3. Lind J, Wegelius C. Angiocardiographic studies on the human foetal circulation. Pediatrics 1949;4:391-400.
4. Rudolph AM, Heymann MA, Teramo K, Barrett C, Räihä N. Studies on the circulation of the previable human fetus. Pediatr Res 1971;5:452-65.
5. Behrman RE, Lees MH, Peterson EN, de Lannoy CW, Seeds AE. Distribution of the circulation in the normal and asphyxiated fetal primate. Am J Obstet Gynecol 1970;108:956-69.
6. Kiserud T, Eik-Nes SH, Blaas H-G, Hellevik LR. Ultrasonographic velocimetry of the fetal ductus venosus. Lancet 1991;338:1412-4.
7. Kiserud T, Eik-Nes SH, Hellevik LR, Blaas H-G. Ductus venosus – a longitudinal doppler velocimetric study of the human fetus. J Matern Fetal Invest 1992;2:5-11.
8. Kiserud T, Eik-Nes SH, Blaas H-G, Hellevik LR. Foramen ovale: an ultrasonographic study of its relation to the inferior vena cava, ductus venosus and hepatic veins. Ultrasound Obstet Gynecol 1992;2:389-96.
9. Kiserud T, Eik-Nes SH, Blaas H-G, Hellevik LR, Simensen B. Ductus venosus blood velocity and the umbilical circulation in the seriously growth retarded fetus. Ultrasound Obstet Gynecol 1993.
10. Kiserud T, Eik-Nes SH, Hellevik LR, Blaas H-G. Ductus venosus blood velocity changes in fetal cardiac diseases. J Matern Fetal Invest 1993;3:15-20.
11. Kiserud T, Rasmussen S, Skulstad S. Blood flow and the degree of shunting through the ductus venosus in the human fetus. Am J Obstet Gynecol 2000;182:147-53.
12. Kiserud T, Kessler J, Ebbing C, Rasmussen S. Ductus venosus shunting in growth-restricted fetuses and the effect of umbilical circulatory compromise. Ultrasound Obstet Gynecol 2006;28:143-9.
13. Bellotti M, Pennati G, De Gasperi C, Battaglia FC, Ferrazzi E. Role of ductus venosus in distribution of umbilical blood flow in human fetuses during second half of pregnancy. Am J Physiol Heart Circ Physiol 2000;279:H1256-63.
14. Tchirikov M, Kertschanska S, Schroder HJ. Obstruction of ductus venosus stimulates cell proliferation in organs of fetal sheep. Placenta 2001;22:24-31.
15. Tchirikov M, Kertschanska S, Sturenberg HJ, Schroder HJ. Liver Blood Perfusion as a Possible Instrument for Fetal Growth Regulation. Placenta 2002;23:S153-S8.
16. Kessler J, Rasmussen S, Godfrey K, Hanson M, Kiserud T. Venous liver blood flow and regulation of human fetal growth: evidence from macrosomic fetuses. Am J Obstet Gynecol 2011;204:429e1-7.
17. Godfrey K, Haugen G, Kiserud T, et al. Fetal liver blood flow distribution: role in human developmental strategy to prioritize fat deposition versus brain development. PLoS ONE 2012;7:e1759.
18. Haugen G, Hanson M, Kiserud T, Crozier S, Inskip H, Godfrey K. Fetal liver-sparing cardiovascular adaptations linked to mother's slimness and diet. Circ Res 2005;96:12-4.
19. Edelstone DI, Rudolph AM, Heymann MA. Effect of hypoxemia and decreasing umbilical flow on liver and ductus venosus blood flows in fetal lambs. Am J Physiol 1980;238:H656-H63.
20. Itskovitz J, LaGamma EF, Rudolph AM. The effect of reducing umbilical blood flow on fetal oxygenation. Am J Obstet Gynecol 1983;145:813-8.
21. Rudolph AM. Distribution and regulation of blood flow in the fetal and neonatal lamb. Circ Res 1985;57:811-21.
22. Paulick RP, Meyers RL, Rudolph CD. Venous responses to hypoxemia in the fetal lamb. J Dev Physiol 1990;14:81-8.
23. Kiserud T, Ozaki T, Nishina H, Rodeck C, Hanson MA. Effect of NO, phenylephrine, and hypoxemia on ductus venosus diameter in fetal sheep. Am J Physiol Heart Circ Physiol 2000;279:H1166-71.
24. Tchirikov M, Kertschanska S, Schröder H. Differential effects of catecholamines on vascular rings from ductus venosus and intrahepatic veins of fetal sheep. J Physiol 2003;284:519-26.
25. Kiserud T, Hellevik LR, Eik-Nes SH, Angelsen BA, Blaas HG. Estimation of the pressure gradient across the fetal ductus venosus based on Doppler velocimetry. Ultrasound Med Biol 1994;20:225-32.
26. Paulick RP, Meyers RL, Rudolph CD, Rudolph AM. Venous and hepatic vascular responses to indomethacin and prostaglandin E1 inthe fetal lamb. Am J Obstet Gynecol 1990;163:1357-63.
27. Kiserud T, Stratford L, Hanson MA. Umbilical flow distribution to the liver and the ductus venosus: an in vitro investigation of the fluid dynamic mechanisms in the fetal sheep. Am J Obstet Gynecol 1997;177:86-90.
28. Coceani F. The control of the ductus venosus: an update. Europ J Ped 1993;152:976-7.
29. Kiserud T. Hemodynamics of the ductus venosus. Eur J Obstet Gynecol Reprod Biol 1999;84:139-47.
30. Hellevik LR, Stergiopulos N, Kiserud T, Rabben SI, Eik-Nes SH, Irgens F. A mathematical model of umbilical venous pulsation. J Biomech 2000;33:1123-30.
31. Hecher K, Snijders R, Campbell S, Nicolaides K. Fetal venous, intracardiac, and arterial blood flow measurements in intrauterine growth retardation: relationship with fetal blood gases. Am J Obstet Gynecol 1995;173:10-5.
32. Bhide A, Acharya G, Bilardo C, et al. ISUOG practice guidelines: use of Doppler ultrasonography in obstetrics. Ultrasound Obstet Gynecol 2013;41:233-9.
33. Kessler J, Rasmussen S, Hanson M, Kiserud T. Longitudinal reference ranges for ductus venosus flow velocities and waveform indices. Ultrasound Obstet Gynecol 2006;28:890-8.
34. Hecher K, Bilardo C, Stigter R, et al. Monitoring of fetuses with intrauterine growth restriction: a longitudinal study. Ultrasound Obstet Gynecol 2001;18:564-70.
35. Huhta J. Diagnosis and treatment of foetal heart failure: foetal echocardiography and foetal hydrops. Cardiol Young 2015;25:100-6.
36. Borrell A. Abnormal ductus venosus blood flow in trisomy 21 fetuses during early pregnancy. Am J Obstet Gynecol 1998;179:1612-7.
37. Borrell A, Costa D, Marinez J, et al. Reversed end-diastolic umbilical flow in a first-trimester fetus with congenital heart disease. Prenat Diagn 1998;18:101-5.
38. Fugelseth D, Kiserud T, Liestol K, Langslet A, Lindemann R. Ductus venosus blood velocity in persistent pulmonary hypertension of the newborn. Arch Dis Child Fetal Neonatal Ed 1999;81:F35-9.
39. Fugelseth D, Lindemann R, Liestol K, Kiserud T, Langslet A. Ultrasonographic study of ductus venosus in healthy neonates. Arch Dis Child Fetal Neonatal Ed 1997;77:F131-4.
40. Fugelseth D, Lindemann R, Liestol K, Kiserud T, Langslet A. Postnatal closure of ductus venosus in preterm infants or = 32 weeks. An ultrasonographic study. Early Hum Dev 1998;53:163-9.




